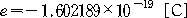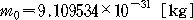▶ 원자와 전자
▶
원자로부터의 전자기파 방사
▶ 전자의
에너지 준위
▶ 연습 문제

![]()
원자구조 ◁
원자핵 ◁
자유전자 ◁
![]()
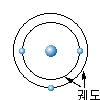
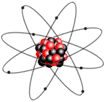 모든 물질은 매우 작은 분자 또는 원자의 결합으로
되어 있으며, 이들 원자는 양전하를 가진 원자핵
(atomic nucleus) 과 음전하를 가진 전자 (electron) 라는 작은
입자로 구성되어 있다. 원자핵의 구조나 원자핵을 둘러싸고 있는 전자의
수에 따라 서로 다른 원자가 된다. 그리고 원자의
모형은 마치 태양 주위를 지구와 같은 행성들이 돌고 있는 것과
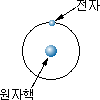
비슷하며, 원자핵을 중심으로 그림 1-1과 같이 몇 개의 전자가
각각 정당한 궤도 위에서 자전하면서 돌고 있다. 이 중에서 수소
원자는 가장 간단한 구조로 되어 있다.
모든 물질은 매우 작은 분자 또는 원자의 결합으로
되어 있으며, 이들 원자는 양전하를 가진 원자핵
(atomic nucleus) 과 음전하를 가진 전자 (electron) 라는 작은
입자로 구성되어 있다. 원자핵의 구조나 원자핵을 둘러싸고 있는 전자의
수에 따라 서로 다른 원자가 된다. 그리고 원자의
모형은 마치 태양 주위를 지구와 같은 행성들이 돌고 있는 것과
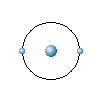
비슷하며, 원자핵을 중심으로 그림 1-1과 같이 몇 개의 전자가
각각 정당한 궤도 위에서 자전하면서 돌고 있다. 이 중에서 수소
원자는 가장 간단한 구조로 되어 있다.
그림 1-1 원자의 구조

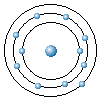
원자핵은 단지 양전하로만 뭉쳐 있는 것이 아니고, +e[C]의 양전하를 가진 양성자 (proton)와 이것과 거의 같은 질량을 가지지만, 전하는 가지고 있지 않은 중성자 (neutron) 가 강한 핵력으로 결합된 구조로 되어 있다. 양성자나 중성자는 질량이 전자의 약 1840배나 되는 입자이며, 이들을 한데 합하여 핵자 (nucleon) 라 한다. 그러므로 원자의 질량은, 전자의 질량을 무시하고 거의 핵자의 질량만이라고 생각해도 된다. 원자핵의 양성자 수 Z는, 핵의 양전하 수 (e를 단위로 하여) 를 나타내고 동시에 원자 번호를 나타낸다. 원소의 종류에 따라서 양성자의 수 Z는 일정하나, 중성자의 수는 Z에 가까운 값 중에서 몇 가지의 값을 가지는 경우가 있다. 이를테면, 산소(O)의 원자 번호는 Z=8 (양성자 8개) 이나 중성자 수는 8,9,10개 중 어느 하나를 가진 원자들이 있다. 이와 같이, 같은 원소이지만 원자 1개씩 비교하면 양성자 수는 같으나, 핵자의 총수로 나타내는 질량수가 다른 원소들이 있는데, 이들을 동위 원소 (isotope) 라 한다.

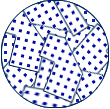
일반적으로, 금속은 그림 1-2와 같이 다수의 원자가 규칙적인 그물 눈금 (격자) 모양으로 배열된 결정 (crystal) 구조로 되어 있다. 예를 들면, 반도체 재료에 사용되는 실리콘(Si)은 결정체의 전 영역에 걸쳐 그림 1-2의 (a)와 같이 규칙적으로 배열되어 있다. 이와 같은 구조를 단결정이라 한다. 그러나 도전 재료로 많이 쓰이는 구리는 이러한 단결정 조각들이 많이 모여 있는 구조로 되어 있다. 이와 같은 구조를 다결정이라 하며, 그림 (b)와 같은 모양이다.
(a) 단결정 |
(b) 다결정 |
그림 1-2 결정 구조의 모형
|
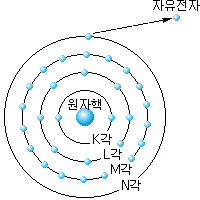
그림 1-3 구리의 원자 모형 |
구리 원자는, 그림 1-3과 같이 29개의 궤도 전자가 제각기 무리를
이루고 일정한 궤도를 따라 원자핵 주위를 돌고 있다. 이러한 궤도를
전자각
(electron shell) 이라 하고, 원자핵의 가까이로부터 순서대로 K각,
L각, M각 및 N각이라 한다.
구리의 경우, 궤도
전자의 수 는 K각에 2개, L각에 8개, M각에 18개, N각에 1개가 있다.
이 경우, 가장 바깥에 있는 N각의 궤도 전자는 원자핵으로부터의 구속력이
가장 약해, 외부로부터 에너지가 주어지면 원자의
구속으로부터 이탈하여 자유로운 운동을 할 수 있는 자유 전자로
된다. 자유 전자의 전하량 e와 질량 m0은 다음과 같다.